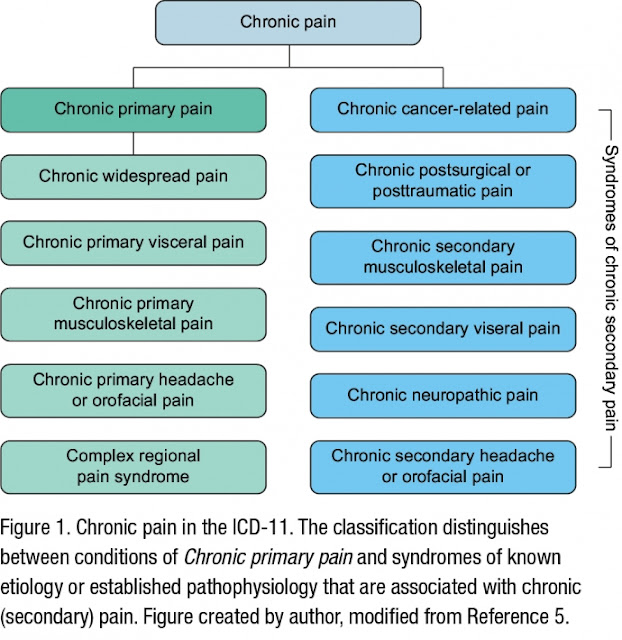
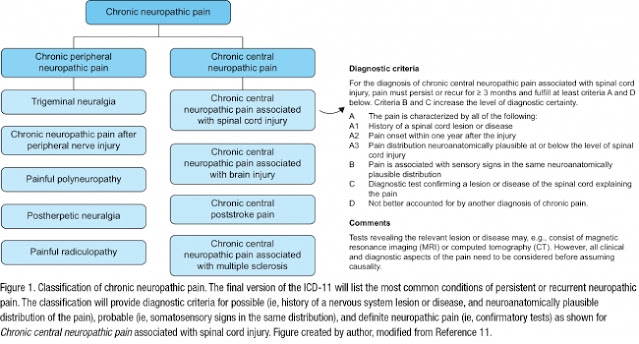
Elaborazione del dolore nel cervello: cosa c'è di diverso nel dolore cronico?
Questo film è stato sviluppato per illustrare i processi estremamente complessi di trasmissione del dolore e di elaborazione del dolore nel cervello. Il film delinea cosa succede nel cervello con il dolore acuto e come questo è diverso con il dolore cronico.
Il film è rivolto a bambini, adolescenti e giovani adulti con dolore cronico, così come alle loro famiglie, amici e professionisti dalle cure primarie a quelle terziarie. Tutto ciò che percepiamo dal nostro ambiente e dalla nostra esperienza soggettiva viene trasmesso al nostro cervello come stimoli: ad esempio gli stimoli di movimento provenienti dai muscoli, gli stimoli sensoriali come l'udito e gli stimoli dolorosi.
La prima parte del film spiega come funziona la trasmissione del dolore nel dolore acuto, comprese quali parti del nostro cervello svolgono un ruolo nell'elaborazione del dolore: la corteccia prefrontale, il talamo, l'amigdala, la corteccia somatosensoriale. Un'intera rete è coinvolta nell'elaborazione del dolore. C'è uno scambio di informazioni tra le regioni cerebrali coinvolte tramite connessioni neurali. La corteccia prefrontale attira l'attenzione sugli stimoli più importanti attualmente e li comunica al talamo. Il talamo è collegato all'amigdala, che è responsabile dell'elaborazione delle emozioni. Gli stati emotivi hanno un impatto sull'intensità della trasmissione degli stimoli. Il talamo funziona come un filtro, smistando gli stimoli in arrivo e inoltrando i segnali più importanti in modo che ne diventiamo consapevoli. Infine, gli stimoli dolorosi in arrivo sono assegnati a una posizione del dolore corporeo che è mappata nella corteccia somatosensoriale.
La seconda parte del film mostra cosa succede di diverso nell'elaborazione del dolore nel cervello nel caso di dolore cronico e come si verifica la sensibilizzazione al dolore. La corteccia prefrontale richiama ripetutamente l'attenzione su situazioni potenzialmente dolorose. Molte situazioni di vita stressanti e forti emozioni portano l'amigdala ad aumentare la trasmissione degli stimoli dolorosi attraverso il talamo. Prestando attenzione al dolore, nel talamo arrivano più stimoli dolorosi già noti. A causa dell'abbondanza di piccoli e grandi stimoli di movimento e dolore in entrata e della mancanza di inibizione da parte della corteccia prefrontale e dell'amigdala, vengono trasmessi più stimoli di prima per l'elaborazione cosciente. Anche gli stimoli di movimento vengono erroneamente percepiti come stimoli dolorosi. Il talamo è diventato più sensibile agli stimoli del dolore. L'aumento del numero di stimoli dolorosi e di movimento in entrata raggiunge una corteccia somatosensoriale sempre più attivata attraverso connessioni nervose fortemente sviluppate. Anche piccoli stimoli di dolore e movimento vengono percepiti consapevolmente e possono portare a una maggiore sensibilità al dolore e quindi a un aumento del numero di sedi del dolore.